«Das Ganze und seine Teile»

Rektoratsrede,
gehalten von
anlässlich der 165. Stiftungsfeier
|
oder von der Zelle zum Patienten und zurück
Das Ganze und seine Teile deutet auf philosophische Ausführungen hin. Doch das Thema ist naturwissenschaftlich, medizinisch, ganz der Ausbildung des Redners entsprechend. Wir wollen uns die Frage stellen, wie Forschung, in diesem Zusammenhang klinische Forschung, Sinn und Zweck finden und sich damit letztlich auch legitimieren kann. Also doch Philosophie, wenn auch angewandte.
Das Ganze ist ohne seine Teile undenkbar, die Teile finden sich zum Ganzen. Das Ganze ist auch mehr als seine Teile; die Teile reifen gewissermassen, wie sie sich zum Ganzen finden. Was sind die Teile, was das Ganze? Das Ganze, welches. wir besprechen wollen, ist die klinische Forschung, die Teile die Grundlagen, welche sie ermöglichen.
Die folgenden Ausführungen versuchen in einem ersten Schritt, klinische Forschung zu definieren, ihre spezifischen Anforderungen und Probleme am Beispiel der Endothelforschung deutlich zu machen, um schliesslich Lehren zu ziehen und Vorschläge zu ihrer Verbesserung zu machen.
Definition der klinischen Forschung
Was ist klinische Forschung? Es ist das Bemühen, die Entstehung von
Erkrankungen auf der Grundlage der Wissenschaften zu verstehen und
dieses Wissen zur Entwicklung wirksamer Behandlungsmethoden für
Kranke zu verwenden. Klinische Forschung kann, aber sie muss keineswegs
direkt patientenorientiert sein. Was klinische Forschung ausmacht,
ist die Fragestellung, nicht die experimentelle Situation. Klinische Forschung,
das ist die Untersuchung von Patienten mit einer bestimmten
Erkrankung, aber ebenso eine Studie an kultivierten Zellen im Kontext
eines klinischen Problems. Es ist gerade diese Vielstufigkeit, welche klinische
Forschung ausmacht und auch ihre Probleme schafft, welche wir
besprechen möchten. Klinische Forschung ist also nicht auf eine
Methodik beschränkt; sie verwendet heute sowohl die Techniken der
Molekular- und Zellbiologie wie auch der Biochemie, Physiologie,
Pharmakologie, Epidemiologie und Biometrie. Auch die Geisteswissenschaften
können beigezogen werden, so es um Fragen der Psychologie
oder, heute mehr denn je, der Ökonomie geht. Kurz: Klinische Forschung
ist Vielfalt, ein Schnittpunkt, der sich durch die Fragestellung und nicht
die Methodik definiert.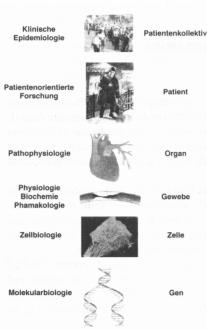
Diese Vielfalt ist Chance und Herausforderung zugleich. Chance, als es ihr freisteht, alle verfügbaren wissenschaftlichen Möglichkeiten, von der Molekularbiologie bis zur klinischen Epidemiologie, einzusetzen (Abb. 1) Herausforderung, weil die Integration dieser verschiedenen Forschungsebenen nicht einfach gelingt. Die letztere Problematik erinnert an die indische Parabel der 12 blinden Männer und des Elefanten: Jeder der 12 Blinden, es können durchaus auch Frauen sein, aber die indische Tradition sieht hier Männer vor, ertastet einen Teil des Elefanten, den Schwanz, die Beine, den Rücken, den Kopf, die Ohren oder den Rüssel; wenn jeder für sich seine Eindrücke beschreibt, so schildert jeder ein anderes Tier, der wirkliche Elefant aber kommt in den Einzelbeschreibungen nie zum Vorschein.
Das Ganze und seine Teile
Das Ganze und seine Teile: Erkenntnis, die im Teil gewonnen wurde, kann, aber muss nicht für das Ganze gelten. Das Ganze und seine Teile, «omnis cellula e cellula», ist ein Axiom, welches Rudolf Virchow, der geniale Pathologe des 19. Jahrhunderts, geprägt hat; und damit sind wir bei der Zelle. Dieses Axiom besagt, dass wir alle, die ganze Menschheit, aus einer Zelle entstanden sind. Was liegt näher, als die Zelle zu verstehen, um das Ganze zu erklären? Doch bald wird klar: Obschon gilt: «omnis cellula e cellula», das Organ, der Organismus, ist mehr als die Summe dieser Teile, seiner Zellen. Alle Zellen sind gleich, alle haben sie einen Kern, die Erbsubstanz (Abb. 1), die DNS findet sich bei allen Zellen in identischer Form, Zellmembran, Signalübertragungsmechanismen sind in allen Zellen vorhanden — und dennoch: Ein Myozyt des Herzens ist mit einer Nervenzelle nur bedingt vergleichbar, die Zelltypen exprimieren andere Gene und stellen verschiedene Eiweisse her. Zudem, im Zellverband, im Organ wandeln sich die Zellen; aus der Interaktion mit anderen Zellen wird sie sich selbst, eben ein Myozyt oder eine Nervenzelle. Weiter finden sich im selben Gewebe oder Organ, z. B. einem Blutgefäss, nah beisammen Endothelzellen, Gefässmuskelzellen und Fibroblasten, Zellen, welche nur noch verwandt, nicht mehr gleich sind und sich in wichtigen Aspekten unterscheiden —und dabei ist ihr Anderssein aufeinander ausgerichtet, vernetzt fügen sich die Teile zum Ganzen. Somit sind Zellen einzeln und im Verband, im Organ unvergleichbar. Schon die Co-Kultur verschiedener Zellen zeigt uns die Bedeutung dieser Vernetzung, die gegenseitige Beeinflussung, kurz die Einsicht, dass das Ganze mehr ist als seine Teile. Doch die Komplexität wächst weiter: Das Organ lässt sich erst im Ganzen des Organismus verstehen. Ist es schliesslich ein Patient, welcher uns als
klinische Forscher interessiert, so bewegt sich dieser weiter in einem Umfeld, d.h. einer Familie, Gesellschaft, einer Kultur (Abb. 1).
Stufen der klinischen Forschung
Wie ist dies alles zu bewältigen? Wir wollen vorerst die Probleme etwas ordnen. Die Ebenen der klinischen Forschung, welche die Komplexität des Systems veranschaulichen, lassen sich wie folgt darstellen (Abb. 1): Interessieren wir uns als klinische Forscher z. B. für die koronare Herzkrankheit, welche Angina pectoris und Herzinfarkt verursacht, so sehen wir zuerst ein Individuum, einen Menschen, einen Organismus, welcher unter dieser Krankheit leidet. Wir kennen weiter das Organ, das Herz, welches von der Krankheit befallen ist. Wir wissen weiter — und zwar bereits von den englischen Klinikern des 18. Jahrhunderts und später auch von den grossen deutschen Pathologen des 19. Jahrhunderts um Virchow und Rokitansky —, dass es die Herzkranzgefässe sind, welche bei diesen Patienten Verkalkungen und Einengungen aufweisen. Diese Einengungen behindern den Blutfluss, zumal unter körperlicher und seelischer Belastung, wenn Angina pectoris auftritt, und wenn sich die Gefässe verschliessen, kommt es zum Herzinfarkt.
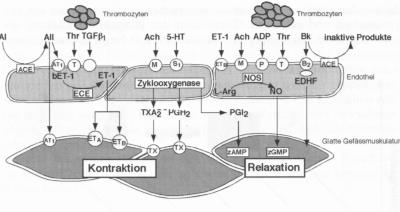
Woraus besteht nun ein Blutgefäss (Abb. 2)? Wir haben in den letzten 20 Jahren gelernt, dass Gefässe nicht einfach Röhren sind, welche das Blut in Herz, Hirn und Nieren führen, sondern komplex regulierte Organe, welche aus Endothelzellen, welche die Innenhaut bilden, und Gefässmuskel- und Bindegewebszellen, welche die Gefässwand bilden, bestehen. Diese Zellen, z. B. Endothelzellen, lassen sich in Kulturschalen züchten und auf ihre Eigenschaften untersuchen. Interessieren wir uns nun für eines ihrer typischen Produkte, wie z. B. das Enzym Nitric Oxide Synthase, ein Eiweiss, welches Stickstoffmonoxid, also das freie Radikal NO, aus der Aminosäure L-Arginin herstellt, so können wir dies in der Zelle mit speziellen Antikörpern darstellen und lokalisieren. Wir können uns schliesslich für seine Regulation interessieren und die Promoterregion, d.h. den Schalter seines Gens, studieren. Dabei lässt sich feststellen, dass mechanische Zugkräfte wie Stretch die Expression dieses Enzyms regulieren, d.h. das Gen, welches dafür kodiert ist, anschalten. Damit sind wir in der untersten Ebene angelangt; wir könnten aber auch hier beginnen und uns fragen, ob dieses erst vor wenigen Jahren entdeckte Enzym für die Endothelzellen, für ein Blutgefäss, für die Herzfunktion von Bedeutung wäre und ob eine Störung in der Funktion dieses Enzyms krank machen könnte, kurz, ob die Nitric Oxide Synthase bei der koronaren Herzkrankheit eine Rolle spielt (Abb. 1): Von der Zelle zum Patienten und zurück.
Probleme der klinischen Forschung
Diese vertikale Vernetzung der klinischen Forschung scheint überzeugend und klar. Und dennoch ist jeder Schritt voller Schwierigkeiten. Wie wir das Ganze in seine Teile zerlegen, verändern sich auch die Teile, die wir betrachten; gewissermassen eine Unschärferelation in der Biologie. Wir wissen, dass sich Zellen in Kultur verändern, gewisse Moleküle nicht oder stärker exprimieren. Dies kann je nach Fragestellung nützlich oder problematisch sein; immerhin macht es Probleme angehbar, indem es Komplexität reduziert. Ein weiteres kommt hinzu, die Speziesunterschiede, die Verschiedenheiten der Arten, welche eine Übertragung der gewonnenen Ergebnisse auf den Menschen nicht selbstverständlich machen. Vielleicht haben wir tatsächlich kultivierte Zellen des Menschen zur Verfügung, aber es sind nicht durchwegs die richtigen. Sie stammen vielleicht von der stets verfügbaren Nabelschnur und nicht von der Herzkranzarterie,
welche uns wirklich beschäftigt, aber weniger erhältlich ist.
Ja, um den intakten Organismus untersuchen zu können, sind wir aus
praktischen und ethischen Gründen in der klinischen Forschung oft
gezwungen, auf andere Spezies auszuweichen, z. B. Nager mit bestimmten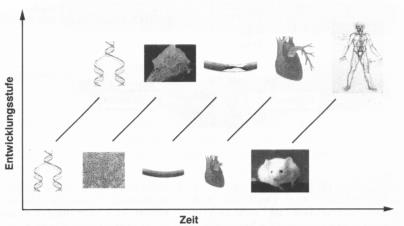
Erkrankungen, welche dem Patienten mehr oder weniger nahe kommen, zu untersuchen (Abb. 3). Kurz und gut: Wenn sich die Teile wieder zum Ganzen fügen sollen, müssen wir alle diese Aspekte, diese Einschränkungen berücksichtigen und gewissermassen stufenweise eine Annäherung an die Wahrheit versuchen.
Wen wundert's daher, dass der Schweizerische Wissenschaftsrat Schwierigkeiten bei der Umsetzung des Wissens der Grundlagenforschung in die klinische Praxis ortet. Dabei wäre die Ausgangslage in der Schweiz geradezu ideal: Wie die Zeitschrift Science im letzten Jahr feststellte, ist die Grundlagenforschung in der Schweiz international an der Spitze. Sowohl gemessen an der Publikationsleistung, d. h. der Anzahl Publikationen, wie deren Resonanz, d. h. dem Zitationsindex ihrer Forscher, und auch gemessen an der Zahl von Nobelpreisträgern pro Kopf der Bevölkerung findet sich die Schweiz in den vordersten Rängen. Auch was die Entwicklung neuer Moleküle durch die forschende pharmazeutische Industrie betrifft, mischt die Schweiz vorne mit. Eine Analyse der klinischen Forschung allerdings ergab ein weniger erfreuliches Bild: Obschon wir auch hier Beispiele grosser Leistungen wie die Entdeckung von Insulin-like growth factor und seiner Bedeutung bei Stoffwechselleiden,
die Entwicklung der Ballondilatation von Koronarstenosen oder der orthopädischen Chirurgie kennen, zeigt die Gesamtanalyse zwar eine rege Publikationstätigkeit der klinischen Forscher, aber — von Ausnahmen in gewissen Bereichen abgesehen —eine geringe Resonanz. Ein weiteres bedeutendes Defizit zeigt sich beim letzten Schritt der Umsetzung in die Klinik, den Multizenterstudien, in welchen an Hunderten oder Tausenden von Patienten neue Therapiekonzepte letztlich geprüft, ihre Wirksamkeit nachgewiesen und ihre Verwendung in den klinischen Alltag eingefügt wird. Hier finden wir Schweizer Zentren, von Ausnahmen abgesehen, meist nur als «innocent bystanders» und nicht als führende oder gestaltende Kräfte.
Doch betrachten wir zuerst den Prozess der klinischen Forschung an einem Beispiel. Wie könnte so etwas ablaufen, und was können wir daraus lernen?
Endothelforschung als Beispiel
Wir schreiben das Jahr 1980. Die koronare Herzkrankheit ist inzwischen die häufigste Todesursache in der Schweiz und in westlichen Ländern. Die Koronarstenose und -verschluss sind als Ursachen von Angina pectoris und Infarkt bekannt. Die Bypassoperation gehört zur Standardtherapie, die Ballondilatation ist gerade von Grüntzig in Zürich eingeführt worden. Und dennoch liegt eine Lösung der Problematik in weiter Ferne. Die Sterblichkeit der Erkrankung sinkt nur wenig, die Bypasserkrankung schränkt die Erfolge der Operation ein, die Ballondilatation führt nur bei einem Teil der Patienten zum Erfolg, ein Drittel entwickelt eine Restenose, d.h. eine Wiedereinengung, nach wenigen Monaten. Es wird offensichtlich, dass Gefässe keine Schläuche, sondern lebende Organe sind. Nur ein besseres Verständnis ihrer Biologie kann die Behandlung weiterbringen. In diesem Jahr 1980 führt der Pharmakologe Robert Furchgott in New York, d. h. eigentlich sein Laborant, ein scheinbar belangloses Experiment an der isolierten Hauptschlagader des Kaninchens durch. Das Axiom «Science is a history of mistakes and the better the funding the longer it takes to make the mistake» gilt auch hier: Der Laborant führt Konzentrations-Antwort-Kurven auf Noradrenalin und Azetylcholin durch, beides bekannte Hormone, welche dieses Gefäss verengen. In der Mitte des Experiments verwechselt der Laborant die Substanzen und beobachtet in der mit Noradrenalin vorkontrahierten Aorta nach Gabe von Azetylcholin überraschenderweise eine Relaxation, d.h. eine Erweiterung, des Gefässes (Abb. 4). Er ruft seinen Chef und hier zeigt sich: «le hasard ne touche que l'esprit préparé» — Robert
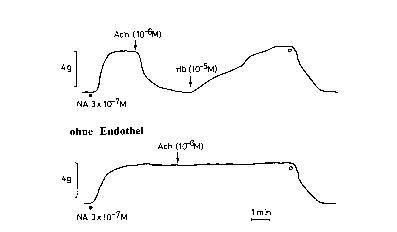
Furchgott postuliert einen Relaxationsfaktor, welcher in der Gefässwand gebildet und durch Acetylcholin freigesetzt wird. Bald zeigt sich, dass das Endothel, d. h. die Innenschicht der Gefässe, diesen Faktor bildet und dass er bisher unbemerkt blieb, weil bei der Präparation der Gefässsegmente für die Untersuchung in Organkammern diese feine Innenschicht meist verletzt wurde. Furchgott nennt ihn daher Endotheliumderived Relaxing Factor oder EDRF. Nach vielen Schwierigkeiten wird diese Beobachtung auch publiziert und stimuliert sowohl die Grundlagen- und klinische Forschung. Es stellt sich die Frage: Was ist die chemische Identität dieses Faktors, und wie wird er produziert? Und weiter: Wenn das Endothel, welches offensichtlich bei Patienten mit koronarer Herzkrankheit verändert ist (Abb. 5), einen Relaxationsfaktor freisetzt, könnte dies bei der Erkrankung eine Rolle spielen. Die Forschung geht also schon hier in beide Richtungen: nach unten und nach oben.
Für die klinische Forschung gilt es auch noch ein spezielles Problem zu lösen, nämlich: Gilt, was beim Kaninchen gefunden wurde, auch beim Menschen? Nach einem negativen Bericht an post mortem gewonnenen Gefässen des Menschen konnten wir an intraoperativ gewonnenem humanen Material Endothel-abhängige Relaxationen erstmals auch in isolierten menschlichen Arterien (Abb. 4) und schliesslich einige Jahre später auch in vivo an Patienten nachweisen. Zahlreiche Arbeitsgruppen beobachteten in der Folge Störungen der Endothelabhängigen Relaxation bei experimentellem Bluthochdruck, bei Hypercholesterinämie und Diabetes. Es wird klar: Das Endothel ist ein Zielorgan aller bekannter Risikofaktoren für Herz- und Kreislauferkrankungen,
Gesunde Koronar-Arterie Arteriosklerotische Koronar-Arterie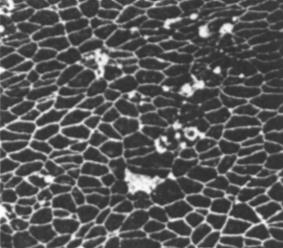
Abb. 5:
Morphologische Veränderungen der Endothelzellen bei Patienten mit koronarer
Herzkrankheit (rechts) im Vergleich zu Gesunden (links). (Nach Tschasov 1987)
5:
Morphologische Veränderungen der Endothelzellen bei Patienten mit koronarer
Herzkrankheit (rechts) im Vergleich zu Gesunden (links). (Nach Tschasov 1987)
gewissermassen ein «final common pathway», und deshalb für die klinische Forschung von grösstem Interesse. Doch noch immer ist unklar, was eigentlich diese Relaxation verursacht. 1985 schlägt Furchgott aufgrund theoretischer Überlegungen das kurzlebige Radikal Stickstoffmonoxid oder Nitric Oxide (NO) vor, und Salvador Moncada liefert kurz darauf den biochemischen Nachweis in kultivierten Endothelzellen (Abb. 2).
Von Nitric oxide zu Endothelin
Kurz vor diesem Durchbruch versuchte eine Arbeitsgruppe um Robert Highsmith in Cincinnati mit eben diesen kultivierten Endothelzellen auch den Relaxationsfaktor EDRF zu identifizieren; zu ihrer Verblüffung beobachteten sie aber, dass die für diesen Zweck kultivierten Endothelzellen, isolierte Gefässe, welche mit ihnen in Kontakt gebracht wurden, verengten, d. h. kontrahierten, und nicht erweiterten. Sie postulierten daher einen neuen endothelialen Kontraktionsfaktor; doch das Manuskript wird von der Zeitschrift «Science» abgelehnt. Ein Japaner in Tsukuba liest wenig später ihre schliesslich in einem weniger bekannten Journal publizierte Arbeit und identifiziert diesen Faktor als ein Eiweiss mit 21 Aminosäuren und nennt es Endothelin (Abb. 2). Heute wissen wir, dass Endothelzellen in Kultur die Expression der Nitric Oxide Synthase herunterregulieren und damit immer mehr Endothelin produzieren, d. h. dass die Kultur eine Eigenschaft dieser Zellen so verstärkte, dass sie unter diesen Bedingungen entdeckbar wurde. Damit ist das Ying-Yang Prinzip
der Endothelfunktion mit einem Relaxations- und einem Kontraktionsfaktor (Abb. 2) geboren und stimuliert die Grundlagen — wie die klinische Forschung ungemein. In rascher Reihenfolge wird das Gen kloniert, die Regulation der Produktion von Endothelin charakterisiert und die Rezeptoren kloniert. Eine ähnliche Entwicklung macht auch NO durch.
Von der Zelle zum Organismus
Nun galt es diese Konzepte auf Organe, auf den intakten Organismus und
den Patienten zu übertragen. Man ging davon aus, dass Nitric Oxide und
Endothelin unmittelbar am Ort ihrer Produktion, d. h. in der Gefässwand,
wirken, also ein autokrines und parakrines System darstellen, ganz im
Gegensatz zu anderen Regulatoren des Kreislaufs, welche zirkulierende
Hormone sind und damit endokrin wirken. In der Tat wird in vitro
Endothelin und NO aus Endothelzellen überwiegend zur Gefässwand hin
und nicht ins Lumen freigesetzt. NO hat zudem als freies Radikal eine
Halbwertszeit von nur wenigen Sekunden, womit eine Wirkung nur in
unmittelbarer Nähe des Produktionsortes in Frage kommt. Dennoch wurden
beide Mediatoren im Blut von Patienten bestimmt, was beim Eiweiss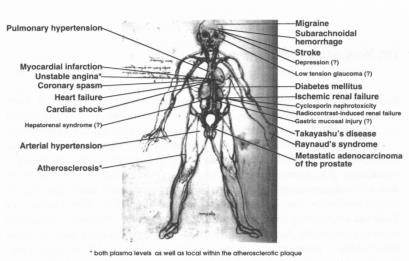
Endothelin mittels Radioimmunoassay leicht gelang. Überraschenderweise
zeigte sich, dass bei einer Reihe von Erkrankungen des Menschen
wie Arteriosklerose, Herzinfarkt sowie Herz- und Nierenversagen die
Werte erhöht waren (Abb. 6). Dennoch, die Werte lagen viel
tiefer als bei allen anderen Hormonen des Kreislaufs, und viele Experten
bezweifelten daher, ob solch geringgradige Erhöhungen überhaupt von
Bedeutung seien. Damit stellte sich die Frage nach der Wirksamkeit dieser
neuen Regulatoren. Infusionsstudien am Vorderarm von gesunden
Probanden ergaben aber rasch, dass die Stimulation der Freisetzung von
NO durch intrarteriell verabreichtes Azetylcholin eine ausgeprägte
Zunahme der Vorderarmdurchblutung verursachte und umgekehrt die
Infusion von synthetischem Endothelin den Blutfluss im Vorderarm
schon bei minimalsten Konzentrationen aufs stärkste verminderte.
Möglicherweise, so die Überlegung, wird daher in der Gefässwand mehr
NO und Endothelin gebildet, als sich aufgrund von Messungen im Blut
erahnen lässt. Dies wurde durch neuentwickelte Messmethoden bestätigt,
welche eine direkte Bestimmung der Konzentration von NO und
Endothelin in der Gefässwand erlaubten. Mehr noch, es zeigte sich eine
ausgesprochene anatomische Heterogenität, d. h. gewisse Gefässgebiete
wiesen höhere Spiegel auf als andere; insbesondere nahm die Gewebekonzentration
des Endothelins von den grossen zu den kleinen Arterien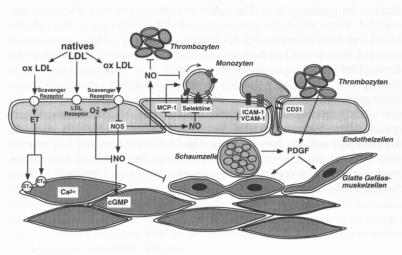
stetig zu. Mehr noch, in verschiedenen Krankheitsmodellen des Alterns, des hohen Blutdrucks und der Arteriosklerose zeigte sich, dass die Gefässwand bereits starke Veränderungen dieser Stoffwechselwege aufweisen kann, ohne dass sich dies im Blut nachweisen lässt. Grosse Gefässe, etwa die Hauptschlagader oder die Halsschlagader, zeigten die deutlichsten Veränderungen (Abb. 7), während andere Blutgefässe noch normal funktionierten, ganz den klinischen Beobachtungen an Patienten entsprechend.
Doch bis hierhin hatte man nur Konzentrationen von neuen Substanzen gemessen, wenn auch am Ort des Geschehens, nämlich in den Blutgefässen: ihre Bedeutung für den gesunden und kranken Organismus liess sich damit nicht bestimmen. Zwei experimentelle Ansätze halfen hier weiter: 1. Die Transfektion beziehungsweise Ausschaltung der Gene für Nitric oxide Synthase bzw. Endothelin und 2. die Entwicklung spezifischer Hemmer von Nitric oxide und Endothelin. Nager, bei welchen die Nitric Oxide Synthase entweder gentechnologisch (d. h. sogenannte eNOS knock outs) oder pharmakologisch (durch Gabe des Enzymhemmers L-NMMA oder L-NAME) ausgeschaltet wurde, zeigten in der Tat eine Erhöhung des Blutdruckes und entwickelten Gefässveränderungen sowie Gehirn- und Nierenschäden. Damit war bewiesen, dass Nitric Oxide ein entscheidender Regulator des Kreislaufes ist und dass sein Wegfall, wie es sich auch bei experimentellen Herz- und Kreislauferkrankungen beobachten liess, Durchblutungsstörungen und damit Organschäden verursachte. Es gab aber auch Überraschungen: Endothelin-knock-out-Mäuse zeigten bei der Geburt ausgeprägte Deformationen im Schlund, Kiefer und Halsbereich; offensichtlich spielte Endothelin in der Entwicklung des Organismus in utero eine sehr wichtige Rolle. Damit nicht genug: Knock outs für den Endothelinrezeptor entwickelten eine Darmerkrankung, welche der deutsche Mediziner Hirschsprung beschrieben hatte, nämlich eine starke Erweiterung des Dickdarms mit entsprechenden Symptomen der Verdauung. Hier zeigte sich, dass die Transfektion und die Ausschaltung von Genen im intakten Organismus entscheidend zur Erkenntnisfindung beiträgt und zuweilen völlig unerwartete Ergebnisse zeitigt, was ihre enorme Bedeutung für die Forschung weiter unterstreicht.
Von experimentellen Modellen zum Patienten
Wie aber sollen diese experimentellen Forschungsergebnisse nun zum Patienten gebracht werden (Abb. 1)? Viele Erkrankungen, zumal diejenigen des Herzens und des Kreislaufs, entwickeln sich erst bei Erwachsenen, ja im fortgeschrittenen Alter. Entsprechend müssen wir davon ausgehen, dass es erst später aufgrund noch zu bestimmender Faktoren zu Veränderungen der Expression verschiedener Gene in der Gefässwand und damit zu Funktionsstörungen und schliesslich Angina pectoris und Infarkt kommt. Wie lässt sich dieses Problem angehen? Es ist denkbar, gewisse Gene zu einem gewissen Zeitpunkt in einem Organismus überzuexprimieren oder zu hemmen. Diese Technologie wird verfügbar, ist aber immer noch aufwendig und schwierig. Andererseits lassen sich neue Stoffwechselwege pharmakologisch hemmen, z. B. durch Moleküle, welche spezifisch einen Rezeptor, d. h. eine Bindungsstelle für eine gewisse Substanz, blockieren. Die Entwicklung solcher neuer Substanzen liegt in der Regel nur in den Möglichkeiten der forschenden Industrie. Gehen wir nun davon aus, dass ein Konzept, z. B. die Bedeutung des Endothels für die Entwicklung der koronaren Herzkrankheit, sich wie geschildert experimentell so entwickelt hat, dass sich eine Überprüfung am Patienten aufdrängt. In unserem Beispiel hatte die forschende Industrie Anfang der neunziger Jahre neue Moleküle, die Endothelinantagonisten, entwickelt, welche spezifisch Endothelinrezeptoren in Gefässen und anderen Geweben blockierten. Hier ergab sich die Chance für eine interessante und produktive Zusammenarbeit mit der forschenden Industrie. In der Folge liess sich zeigen, dass in isolierten Gefässen wie auch der Hautzirkulation des Menschen in der Tat die durch Endothelin verursachten Kontraktionen gehemmt werden, also dass die Endothelinblockade pharmakologisch wirksam ist. In experimentellen Krankheitsmodellen lässt sich ihre mögliche klinische Bedeutung weiter untersuchen. Wir haben zum Beispiel in einem Modell der durch eine Salzdiät hervorgerufenen Hypertonie der Ratte zeigen können, dass Endothelinantagonisten nicht nur den Blutdruck senken, sondern vor allem auch Gefässveränderungen und durch den Blutdruck hervorgerufene Nierenschäden hemmen. Noch interessanter: Bei Mäusen, bei welchen durch knock-out, d. h. Ausschaltung des Gens für das Apolipoprotein E, eine Arteriosklerose hervorgerufen werden kann, liess sich diese Gefässerkrankung durch diese neuen Medikamente ebenfalls hemmen.
Wie weiter? Nun, die Übertragbarkeit dieser Ergebnisse auf den Menschen muss in einem nächsten Schritt für alle experimentellen Erkenntnisse bewiesen werden (Abb. 3). Dazu mussten die Substanzen vorerst auf ihre Verträglichkeit und Sicherheit an gesunden Probanden hin untersucht werden. Diese sogenannten Phase-I-Studien, welche nicht Wirksamkeit, sondern Verträglichkeit und Sicherheit von Medikamenten
testen, werden in der Regel von der Industrie selbst durchgeführt. Allerdings gibt es universitäre Zentren, welche diesen Service anbieten und sich nebenbei bemerkt mit diesen akademisch nicht sehr interessanten, wenn auch für die Entwicklung wichtigen Studien ihre Forschung mitfinanzieren. Wenn es aber zur Testung am Patienten kommt, so kommt die forschende Industrie ohne klinische Zentren nicht aus; umgekehrt kann die universitäre Medizin selber keine Moleküle entwickeln und ist auf die forschende Industrie angewiesen. Falls es sich um ein interessantes Molekül handelt, welches das Zeug zum Medikament hat, entsteht dadurch eine ideale Situation zur Zusammenarbeit, eine Win-Win-Situation, wie die Wirtschaft sagen würde. Nun gibt es aber Hunderte von Universitätskliniken, mit denen eine Zusammenarbeit prinzipiell möglich wäre. Vor Jahren konnten wir uns hier in Sicherheit wiegen, die Aufträge der forschenden Industrie in Basel gleichsam erwarten, gut eidgenössische Solidarität sozusagen. Heute allerdings spricht man Englisch in den Entscheidungsetagen auch in Basel, ein Grossteil der pharmazeutischen Forschung findet in den USA statt, die Einführung neuer Medikamente in den USA, die Bewilligung der FDA, der Federal Drug Administration, steht im Vordergrund und nicht geographische Nachbarschaft, welche nur für wenige Prozent des Marktes steht; Globalisierung auch hier. Was bedeutet dies für eine Universität mit Standort Schweiz? Die Industrie wird sich Partner mit internationalem Ruf suchen, welche für qualitativ hochstehende Forschung stehen und über Strukturen verfügen, welche ihnen die Durchführung klinischer Studien nach heutigen Standards ermöglichen.
Doch zurück zu unserem Beispiel. Vorerst galt es die Wirkung eines Endothelinantagonisten auf den Kreislauf des Menschen zu untersuchen. Bei Patienten, bei welchen bei uns im Herzkatheterlabor normale Befunde erhoben wurden, haben wir einen dieser neu entwickelten Endothelinantagonisten in Zusammenarbeit mit der Kardiologie des Inselspitals Bern infundiert und zeigen können, dass es dabei zu einer Erweiterung der Blutgefässe im systemischen und kleinen Kreislauf sowie zu einer Steigerung der Herzleistung kam, eine Wirkung, welche gleichzeitig von anderen Mitarbeitern der Kardiologie des Universitätsspitals bei Patienten mit Herzschwäche noch eindrücklicher beobachtet werden konnte. Ebenfalls im Herzkatheterlabor haben wir in einer ersten Pilotstudie die Auswirkungen einer Endothelinrezeptorblockade auf den Durchmesser der Herzkrankgefässe von Patienten mit Angina pectoris untersucht; wiederum liess sich bei den meisten Patienten eine Gefässerweiterung nachweisen.
Die Anforderungen von Evidence-based Medicine
So weit, so gut: Doch ist damit schon ein neues Therapiekonzept etabliert? Im Zeitalter von Evidence-based Medicine sicher nicht. Was es braucht, ist 1. eine bessere Einschätzung der wirksamen Dosierungen verschiedener Präparate, 2. ein Wirkungsnachweis auf die sogenannten Surrogatendpunkte (d.h. Blutdruck, Herzleistung, Belastbarkeit und Symptome) in einem grösseren Patientenkollektiv und 3. Langzeituntersuchungen, um eine Verminderung klinischer Ereignisse wie Herzinfarkt u. a. m. sowie eine Verbesserung des Überlebens zu belegen, ein Unterfangen, welches heute Studien mit Tausenden von Patienten erfordert. Solche Untersuchungen sind «in progress». Wir dürfen im Moment eine Multizenterstudie von Zürich aus koordinieren, welche Zentren in der Schweiz, Deutschland und Polen umfasst und die Dosierung eines Endothelinantagonisten bei Patienten mit Herzschwäche untersucht und über mehrere Stufen die Grundlagen für eine grosse Überlebensstudie in dieser Patientengruppe schaffen soll. Eine ähnliche Multizenterstudie, welche ebenfalls von Zürich aus koordiniert wird und 800 Patienten in Kanada, Europa, Israel und Australien vorsieht, soll sich der Frage widmen, inwiefern eine Dysfunktion der endothelialen Nitric Oxide Synthase in den Herzkranzgefässen durch Medikamente, in diesem Fall Lipidsenker und Kalziumantagonisten, verbessert werden kann und ob eine verbesserte Endothelfunktion die Entwicklung der Arteriosklerose in diesen Gefässen zu hemmen vermag.
Was ist zu folgern?
Was ist aus diesen Ausführungen zu lernen? Die klinische Forschung ist ein komplexes Unterfangen, ein Prozess, der sich fachlich über mehrere Stufen, zeitlich über Jahre, ja Jahrzehnte erstreckt. Ein Unterfangen, das sich daher nur in einer vertikalen Vernetzung von Grundlagenforschung und Klinik und einer Quervernetzung von Universität und ihren verschiedenen Disziplinen mit der forschenden Industrie verwirklichen lässt. Was kann die Universität dazu beitragen (Tab. 1)? Die Berufung kreativer Köpfe mit einem ausgeprägten Sinn für Teamarbeit über ihren ureigensten Fachbereich hinaus steht an erster Stelle. Ihre Ausbildung sollte klinisch eine gewisse Breite, in der Forschung aber einen festen Schwerpunkt und damit Tiefe haben, der es ihnen erlaubt, international beachtete Forschung zu betreiben und ihnen die nötige Führungslegitimation gibt. Eine Breite, wie sie sich klinische Forscher wie Fanconi oder Hegglin früher leisten konnten, ist heute nicht mehr möglich. Man darf
nicht so breit sein, dass man flach wird, weil Tiefe gefragt ist; was es daher vor allem braucht, ist die Fähigkeit zu vernetztem Denken, welches Forschungsgruppen mit Naturwissenschaftlern, Medizinern und gegebenenfalls anderen Akademikern und schliesslich im grösseren Rahmen auch Kompetenzzentren möglich macht. Ein solch vernetztes Denken muss sich dabei vertikal und horizontal bewegen können.
Ihre Entfaltung aber ist nur innerhalb einer Struktur möglich, die die Universität zu schaffen hat. Hier wird in Zukunft ein Netzwerk, eine Matrix als Organisationsform nötig sein, um die traditionell immer noch vorherrschende departementale und Institutsunterteilung der Fachgebiete zu ergänzen und vielleicht einmal abzulösen. Lehraufträge und Lehrstühle mit fachübergreifendem Inhalt schaffen Verständnis, Interesse und Kontakte, welche die Vernetzung ermöglichen, Grenzüberschreitungen fördern und damit die Umsetzung klinischer Forschung erleichtern. Forschungsgelder —ein entscheidender Ansporn auch im Wissenschaftsbetrieb — sollten als wichtiges Steuerungsmittel der Universitätsleitung ebenfalls nicht fehlen. Die Ressourcen, d. h. der Anspruch auf Raum, Personal und Gelder, mit dem neuen Universitätsgesetz nun in der Hand der Verantwortlichen, soll denjenigen zukommen, welche produktiv sind, und nicht nach historisch gewachsenen Strukturen verteilt werden. Die verfügbaren Nationalfondsgelder und die Publikationsleistung sollten hier als Beurteilungskriterium im Vordergrund stehen. Projekte, welche die Zusammenarbeit über Fachgrenzen hinweg vorsehen, sollten aber auch stark gewichtet werden. Die Wertigkeit von Industrieverträgen, sofern sie der Entwicklung neuer Konzepte und Behandlungen dienen, sollte aufgewertet, ihr Abschluss erleichtert, ja bewusst gefördert werden. Das Interesse der forschenden Industrie an universitären Forschern und ihren Ergebnissen unterstreicht deren Bedeutung und ist damit ein wichtiges Qualitätskriterium.
Nachwuchsförderung
In einigen klinischen Bereichen sind diese Voraussetzungen erfüllt, in anderen bestehen zumindest Bemühungen, diese zu schaffen. Die grössten Probleme liegen im letzten Schritt, der Umsetzung ans Krankenbett. Warum? Es fehlt an Strukturen, an klinischen Forschungszentren, an einer Bereitschaft in den Universitätskliniken, klinische Forschung wirklich ernst zu nehmen, kurz an der Begeisterung und am Durchhaltevermögen für die ureigenste akademische Tätigkeit auf internationaler Stufe, wie wir sie in anderen Ländern finden. Strukturen sind nur Gefässe, welche die Entwicklung von Kreativität erlauben; gerade deshalb sind sie aber nicht zu unterschätzen. Die Ausbildung von Nachwuchskräften ist in
der klinischen Forschung besonders schwierig. Die Entwicklung und Ausbildung umfasst sowohl klinische wie wissenschaftliche Aspekte und muss daher umsichtig über Jahre geplant werden; nur so ist es möglich, sich sowohl im klinischen Bereich des Fachgebietes wie auch in der modernen Forschung Kompetenz anzueignen und diese produktiv umzusetzen. Es braucht also klinische Forschungsstellen nicht nur im Mittelbau, nein vor allem auch auf Assistentenstufe, welche besonders Begabten freistehen, um diesen anspruchsvollen Weg zu gehen, ohne vorzeitig mutlos zu werden. Solche Stellen wären aber nicht fest an eine bestimmte Klinik oder Abteilung zu vergeben, sondern an junge Ärzte und Forscher, welche sich einem Auswahlverfahren unterzogen haben. Nachwuchskräfte sollten aber selber auch früh wissen, was sie wollen. Eine solche Haltung ist aber nur dann nützlich, falls es klinische Chefs gibt, welche bereit sind, angewandte Forschung ernst zu nehmen und klinische Forscher frühzeitig und anhaltend zu beraten und zu fördern.
Strukturelle und personelle Anforderungen für die klinische Forschung
Personen produktive und kreative klinische Forscher. Forschung mit international beachtetem Schwerpunkt. Fähigkeit zu vernetztem Denken, fachübergreifende Grenzgänger.
Strukturen Matrixstrukturen fachübergreifende Lehraufträge gemischte Forschungsgruppen (Naturwissenschaftler, Mediziner, andere Akademiker) Forschungsstellen für Kliniker auf allen Stufen (Assistenten, Oberärzte, leitende Positionen) leistungsorientierte Ressourcenzuteilung (Raum, Personal und Geld) Klinische Forschungszentren
Klinische Forschungszentren
Schliesslich braucht es klinische Forschungszentren, welche patientenorientierte Forschung auf höchstem Niveau ermöglichen und koordinieren. Hier ist heute auch Professionalität angesagt; nur mit Kompetenz in der Gestaltung, Organisation und Durchführung von Grossstudien kann ein klinisches Forschungszentrum bestehen. Nur wo Erfahrung im Umgang mit klinischen Grossstudien besteht, das Personal wie Forschungsschwestern und klinische Forschungsassistenten einen reibungslosen Ablauf ermöglichen und klinische Forschungszentren mehrerer Spitäler optimal koordiniert werden, so dass eine angemessene Anzahl von Patienten innert nützlicher Frist nach den heute erforderlichen Standards wie «Good Clinical Practice» rekrutiert werden, ist ernstzunehmende klinische Forschung und Entwicklung möglich.
Soll dies alles der Staat bezahlen, ein Staat, welcher zunehmend um seine eigene Finanzierung kämpft? Ja und nein. Ja insofern, als er die Grundvoraussetzungen schaffen sollte; aber er sollte seine Mittel bewusst einsetzen, dort, wo sie am meisten bewirken, dort, wo die Saat aufgeht. Nein insofern, als bedeutende externe Mittel zu beschaffen sind. Die Universität als Mischkonzern also, ein Mischkonzern für die Tüchtigen, die Mittel und Freiraum erhalten, sich optimal zu entwickeln zum Wohle der Universität und der Beteiligten. Ein klinisches Forschungszentrum mag hier als Beispiel dienen. Die externe Mittelbeschaffung ist hier in grossem Umfang möglich, interne Unterstützung ist nötig, um dem Zentrum seine Kernkompetenz und seine akademische Unabhängigkeit zu erhalten. In Zürich wurde ein solcher Kern in aller Stille geschaffen, assoziiert und doch ausserhalb der Universität; es ist zu hoffen, dass unsere Universität die Bedeutung und das Potential klinischer Forschungszentren erkennt und diese Idee fördert und integriert zum Wohle aller.
Die zwölf blinden Männer und der Elefant
Die Zusammenführung der zwölf blinden Männer bleibt eine anspruchsvolle Aufgabe, ein Wagnis. Die Vernetzung eines vielseitigen und komplementären Teams bleibt aber heute die einzige Möglichkeit, klinische Forschung zu betreiben, ohne an ihrer Komplexität zu verzweifeln. Wenn es gelingt, bekommen wir den wirklichen Elefanten in seiner vollen Grösse zu Gesicht, ein Unterfangen, das sich somit lohnt, für die Patienten und alle Beteiligten, in- und ausserhalb der Universität; wir sollten deshalb versuchen, diesen Weg gemeinsam zu gehen.
Anmerkung
Der Autor dankt seinen Mitarbeitern der letzten zehn Jahre sowie seinen Lehrern Paul M. Vanhoutte, John T. Shepherd und Fritz R. Bühler für die stimulierende Zusammenarbeit und Freude an der gemeinsamen Forschung. Eigene Forschungen des Autors wurden durch den Schweizerischen Nationalfonds, die Schweizerische Herzstiftung, viele Forschungsstiftungen des In- und Auslandes und Beiträge der forschenden Industrie möglich.
Ausgewählte Literatur
1. Release of endothelin from the porcine aorta: Inhibition by endothelium-derived nitric oxide. (Rapid publication) C. Boulanger, T. F. Lüscher. J. Clin. Invest. 85, 587-590, 1990
2. FERMED 2000 F R. Bühler, H. Burr, Eigenverlag, 1-79,1991.
3. Nitric oxide inhibits angiotensin Il-induced migration of rat aortic smooth muscle cell. R. K. Dubey, E. K. Jackson, T. E Lüscher. J. Clin. Invest. 96, 141-149, 1995
4. Klinische Forschung in den USA. J. A. Fischer, Schweizerischer Wissenschaftsrat, Arbeitsdokument DT 6/1997, S. 67.
5. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. R. F. Furchgott, J. V. Zawadski. Nature 299, 373-376, 1980
6. Difference between endothelium-dependent relaxations in arterial and in venous coronary bypass grafts. T. F. Lüscher, D. Diederich, R. Siebenmann, K. Lehmann, P. Stulz, L. von Segesser, Z. Yang, M. Turina, E. Grädel, E. Weber, F. R. Bühler. N. Engl. J. Med. 319,462-467, 1988
7. Interaction between endothelin-1 and endothelium-derived relaxing factor in human arteries and veins. T. F. Lüscher, Z. Yang, M. Tschudi, L. von Segesser, P. Stulz, C. Boulanger, R. Siebenmann, M. Turina, E R. Bühler. Circ. Res. 66, 1088-1094, 1990
8. The endothelium; Modulator of cardiovascular function. T. E Lüscher, P. M. Vanhoutte. CRC Press, Boca Raton, Fi. 1990, pp. 1-215.
9. The endothelium and cardiovascular disease — a complex relation. T. F. Lüscher. New Engl. J. Med. 330,1081-1083, 1994
10. Mathews Jr.: Quantification and quest for medical certainty. Princeton University Press, Princeton New Jersey, 3-189, 1995.
11. Implications of pulsatile stretch on growth of saphenous vein and mammary artery smooth muscle. H.-G. Predel, Z. Yang, L. von Segesser, M. Turina, E R. Bühler. T. F. Lüscher. Lancet 340, 878-879, 1992
12. Klinische Forschung in Deutschland —jetzt und in Zukunft. Regensburger Universitätskolloquium 1996. Schattauer Verlag, Stuttgart/New York, 1-104.
13. Ziele für die schweizerische Forschungspolitik Periode 2000-2003: Vorschläge des SWR an den Bundesrat. Schweizerischer Wissenschaftsrat, Eigenverlag, Bern 1-90, 1997.
14. Effect of age on kinetics of nitric oxide release in rat aorta and pulmonary artery. (Rapid Publication) M. R. Tschudi, M. Barton, E Cosentino, P. Moreau, G. Noll, T. Malinski, T. E Lüscher. J. Clin. Invest. 98, 899-905, 1996.
15. Anleitung zum ganzheitlichen Denken und Handeln: Ein Brevier für Führungskräfte. H. Ulrich, in: Ulrich H. und Probst G. J. B. Bern-Stuttgart, Hauptverlag, 5-22, 1988.
16. Different interactions of platelets with arterial and venous coronary bypass vessels. Z. Yang, P. Stulz, L. von Segesser, E. Bauer, M. Turina, T. E Lüscher. Lancet 337,939-943, 1991.
17. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. M. Yangisawa, H. Kurihara, S. Kimura, Y. Mitsui, M. Kobayashi, T. X. Watanabe, T. Masaki, Nature 332, 411-415, 1988.






